Lidhja e Van der Waalsit
Në mes të atomeve me shtresa elektronike të mbyllura (gazet fisnike-inerte) ose mes molekulave mund të paraqiten forca bashkëvepruese të njohura si forca të Van der Waalsit. Burim I këtyre forcave është bashkëveprimi mes poleve elektrike, të cilat për nga intensiteti janë shumë të vogla. Forcat e tilla janë shkaktare që gazrat në temperature mjaft të ulëta të kondensojnë në fluide, kurse për temperature akoma më të ulëta në kristale. Por vlenë edhe e kundërta, duke sjell pak energji, d.m.th. duke ngritur temperaturën, lidhjet e tipit të Van der Waalsit prishen. Këto kristale karakterizohen me atome me energji të lartë të jonizimit, si dhe kanë energji të vogël kohezioni. Si të tilla, këto atome mund të paketohen shumë afër njëri tjetrit (rast tipik është struktura kristaline e atomeve të gazrave inerte- përjashtim bëjnë izotopi i tretë(He3) dhe I katërt(He4) I heliumit).

Në parim format e bashkëveprimit të tipit të Van der Waalsit në molekulë janë:
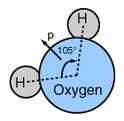
- Forca e bashkëveprimit dipol-dipol mes molekulave me moment dipolar permanent,p.sh. të ashtuquajturat molekulat polare të ujit H2O,
- Forca e bashkëveprimit dipol-dipol, e induktuar mes një molekule me moment dipolar permanent dhe një molekulë tjetër me moment dipolar të induktuar.
- Forca e bashkëveprimit mes dy molekulave ose atomeve jo polare, te të cilat vlera mesatare e momentit dipolar është zero, mirpo si rezultat I një fluktuacioni të densitetit të ngarkesave shumë shkurtë lindin momente dipolare të cilat shkaktojnë tërheqjen e molekulave ose atomeve.
Sipas mekanikës kuantike, gjatë afrimit të atomeve vjen deri tek mbulimi I pjesshëm I reve elektronike të atomeve me ç’rast do të kemi edhe një ndryshim të energjisë së plotë të sistemit. Për një mbulim të plotë në bazë të parimit të Paulit, energjia përkatësisht forca e bashkëveprimit do të jetë refuzuese, kjo ndodhë pasi që ekziston tendenca që elektronet e njërit atom të zënë pjesërisht edhe gjendjen e atomit të dytë, gjë që sipas parimit të Paulit nuk mund të ndodhë, kurse në aspektin energjetik, energjia e plotë e sistemit do të rritet. [1]