Stekiometria
Stekiometria është marrëdhënia midis peshave të reaktantëve dhe produkteve para, gjatë dhe pas reaksioneve kimike .
Stekiometria bazohet në ligjin e ruajtjes së masës, ku masa totale e reaktantëve është e barabartë me masën totale të produkteve, duke çuar në njohurinë se marrëdhëniet midis sasive të reaktantëve dhe produkteve zakonisht formojnë një raport të numrave të plotë pozitivë. Kjo do të thotë se nëse dihen sasitë e reaktantëve të veçantë, atëherë mund të llogaritet sasia e produktit. Në të kundërt, nëse një reaktant ka një sasi të njohur dhe sasia e produkteve mund të përcaktohet në mënyrë empirike, atëherë mund të llogaritet edhe sasia e reaktantëve të tjerë.
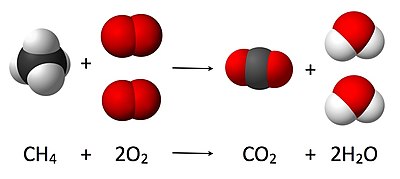
Kjo ilustrohet në imazhin këtu, ku ekuacioni i balancuar është:
Këtu, një molekulë metan reagon me dy molekula oksigjen për të prodhuar një molekulë dioksid karboni dhe dy molekula ujë . Ky ekuacion i veçantë kimik është një shembull i djegies së plotë . Stekiometria mat këto marrëdhënie sasiore dhe përdoret për të përcaktuar sasinë e produkteve dhe reaktantëve që prodhohen ose nevojiten në një reaksion të caktuar. Përshkrimi i marrëdhënieve sasiore midis substancave pasi ato marrin pjesë në reaksionet kimike njihet si stekiometria e reaksionit . Në shembullin e mësipërm, stekiometria e reaksionit mat lidhjen midis sasive të metanit dhe oksigjenit që reagojnë për të formuar dioksid karboni dhe ujë.
Për shkak të lidhjes së njohur të moleve me peshat atomike, raportet që arrihen nga stekiometria mund të përdoren për të përcaktuar sasitë sipas peshës në një reaksion të përshkruar nga një ekuacion i balancuar. Kjo quhet stekiometria e përbërjes .
Stekiometria e gazit merret me reaksionet që përfshijnë gazra, ku gazrat janë në një temperaturë, shtypje dhe vëllim të njohur dhe mund të supozohen se janë gazra idealë . Për gazet, raporti i vëllimit është idealisht i njëjtë sipas ligjit gazit ideal, por raporti i masës së një reaksioni të vetëm duhet të llogaritet nga masat molekulare të reaktantëve dhe produkteve. Në praktikë, për shkak të ekzistencës së izotopeve, masat molare përdoren në vend të kësaj në llogaritjen e raportit të masës.
